Kapitel 2
Vilka analyser kan man göra?
Den moderna diagnostiska processen är komplex och kräver många olika informationstyper för att ge ett adekvat resultat. Allt börjar i patienthistoriken med kartläggning av bland annat symtombild, levnadsvanor och släkthistoria samt grundläggande patientkaraktäristika som ålder, biologiskt kön och vikt. Därefter fortsätter vanligen diagnostiken med icke- eller minimalt invasiva metoder som bildgivande diagnostik och blodprover. De biomarkörer som identifieras i dessa initiala diagnostiska steg är redan många till antalet och omfattas därför inte i detalj här. Detta material fokuserar på det som kan kallas vävnadsbaserad precisionsdiagnostik och går igenom materialtyperna som används och de metoder som används för att analysera både etablerade och nya biomarkörer.
I nästa kapitel kan du läsa om vilka analyser som kan användas för olika ändamål.
Materialtyper inom precisionsdiagnostik
1. Vävnadsprover
- Formalinfixerad paraffininbäddad (FFPE) vävnad: Vanligaste materialtypen, ofta från kirurgiska ingrepp eller biopsier, användbar för att bedöma vävnadsmorfologin men även för DNA-, RNA- och proteinanalyser. Nackdelen är att formalinet är skadligt för DNA och RNA och leder till fragmentering och artefakter vilket försvårar molekylär diagnostik och kräver specialanpassade metoder.
- Färskfrusen vävnad: Ger vanligen mycket högre kvalitet på extraherat DNA och RNA vilket möjliggör ett större utbud av analysmetoder.
2. Cytologiska prover
- Finnålspunktioner (FNA): Ger material framför allt för morfologisk bedömning men molekylära analyser kan i vissa fall genomföras.
- Exfoliativ cytologi: Till exempel borstprov från lunga eller gallvägar, ofta lämpligt för molekylära tester om det finns tillräckligt med material.
3. Flytande biopsier (liquid biopsies)
- Blod (plasma/serum): Framför allt för analys av cirkulerande tumör-DNA (ctDNA) men forskning pågår även kring cirkulerande tumörceller (CTC).
- Urin: Exempelvis vid urologiska cancerformer, analys av tumör-DNA eller proteiner.
- Cerebrospinalvätska: Framför allt vid CNS-relaterade tumörsjukdomar för analys av tumör-DNA eller förekomst av tumörceller.
4. Benmärgsprov
- Relevant främst vid hematologiska maligniteter, ger utöver möjlighet till morfologisk bedömning även underlag för genetiska och molekylära analyser samt för minimal residual disease (MRD)-diagnostik.
5. Övriga kroppsvätskor och provtyper
- Ascites, pleuravätska, perikardvätska: Användbart för cytologi och molekylär analys vid metastatisk sjukdom.
- Saliv: Främst i forskningssammanhang för biomarkörutveckling och som källa för normalt DNA för jämförelse vid storskalig sekvensering.
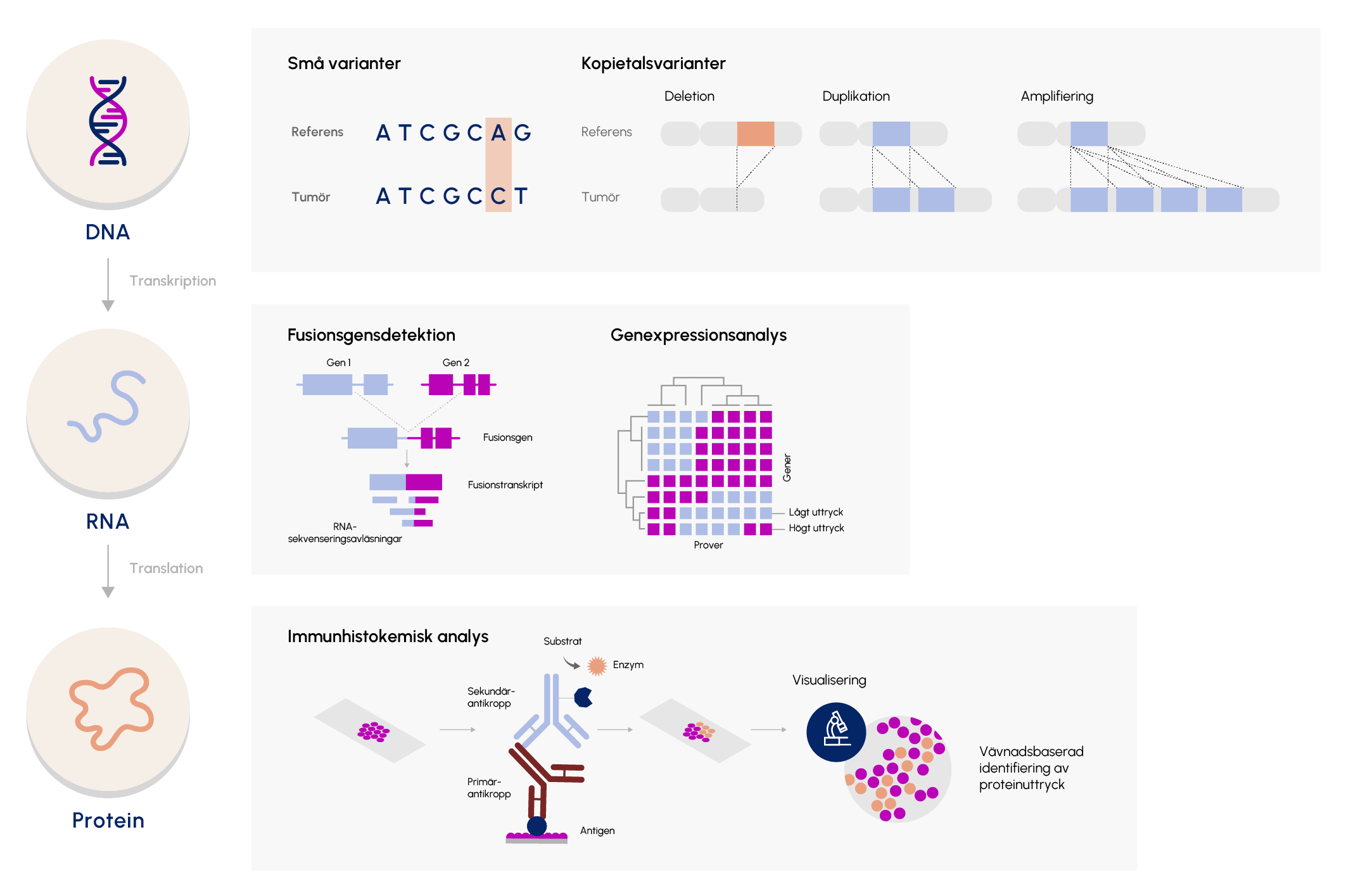
Figur 2. I cellen lagras information som DNA vilket kan transkriberas till RNA och sedan översättas till proteiner och de olika typerna av molekyler möjliggör olika sorters analyser där det i figuren ses några exempel.
Referenser till figuren längst ner på sidan.
Metoderna som möjliggör precisionsdiagnostik
1. Morfologisk bedömning
Inom patologin utgår närapå all diagnostik från en initial histopatologisk analys som du kan läsa om i kapitlet Tumörens resa genom laboratoriet. Med hjälp av standardfärgningar och ett mikroskop kan mycket information uthämtas men viktigast för precisionsdiagnostiken är:
- Är det cancer eller något annat i provet?
- Vilken typ av cancer är det? Här behövs ofta immunhistokemiska färgningar för vägledning.
- Hur mycket material finns det? Hur stor andel cancerceller finns det och i vilken mängd? Räcker det till precisionsdiagnostiska analyser?
- Var finns cancercellerna? Vilken del av materialet ska väljas ut för precisionsdiagnostiska analyser?
2. Immunhistokemisk analys
För att bedöma proteinuttryck i vävnaden används immunhistokemiska (IH) färgningar i mycket hög utsträckning idag. Metoden baseras på att man använder antikroppar för att detektera antigen (del av proteinet av intresse) i vävnadssnitt och därigenom kan bedöma om proteinet uttrycks, vilka celler som uttrycker det och i utvalda fall i vilken grad det uttrycks. IH-färgningar används för att svara på många frågor. I cancerdiagnostik kan det till exempel hjälpa till att bestämma cancerform och vilken subgrupp tumören tillhör, att säkerställa tumörens ursprung och i vissa fall bedöma om tumören uttrycker någon biomarkör som är associerad med behandlingssvar eller prognos.
3. Molekylärgenetiska metoder
-
Next Generation Sequencing (NGS):
– Riktad sekvensering med genpaneler: En central metod inom molekylärpatologin. Med dessa kan utvalda gener relaterade till tumörtyp, behandling eller prognos analyseras.
– Helgenomssekvensering (WGS): Kartlägger hela arvsmassan för mutationer, strukturella förändringar och tumörspecifika signaturer.
– Exomsekvensering (WES): Sekvensering av samtliga proteinkodande gener i genomet.
– RNA-sekvensering (RNA-seq): Kan identifiera genuttrycksprofiler, genfusioner och splicevarianter.
-
Polymerase Chain Reaction (PCR):
PCR är en metod för att kopiera DNA eller RNA och som används i många molekylära metoder. Två specifika användningar av metoden är:
– Real-time PCR (RT-PCR): Snabb detektion och kvantifiering av mutationer, genfusioner och genuttryck.
– Digital PCR (ddPCR): Mycket känslig metod för kvantifiering av lågfrekventa mutationer i vävnad eller cirkulerande tumör-DNA (ctDNA).
-
FISH (fluorescens in situ-hybridisering):
Direkt visualisering av specifika genamplifieringar, deletioner eller translokationer med hjälp av fluorescerande prober riktade mot avvikelsen.
-
Microarray-teknik (DNA- eller RNA-array):
Analys av metyleringsprofil, kopietalsvariationer (Copy Number Variations, CNVs) eller genuttrycksprofiler i stor skala.
4. Digital patologi och bildanalys (AI-baserad diagnostik)
På senare tid har man även inom patologin börjat arbeta mer och mer digitalt. Detta möjliggör datorstödda tolkningar med avancerade AI-baserade bildanalytiska system av histologiska bilder. Utbudet av AI-stödda analyser i klinisk vardag är idag begränsat men ett exempel på användningsområde är system som hjälper till att räkna hur många celler i ett tumörpreparat som uttrycker proliferationsmarkören Ki67. Utvecklingen går fort och flera applikationer förväntas de kommande åren inklusive förfinad subgruppering av tumörer, prediktion av genetiska avvikelser (t.ex. mikrosatellitinstabilitet) och identifiering av kända riskfaktorer från tumörens växtmönster.
Det här beskriver grunderna för den diagnostiska verktygslådan som används vid vävnadsbaserad diagnostik idag. Som med all diagnostik är metoderna inte ersättningar för varandra utan komplementära. Molekylärgenetiska svar måste alltså bedömas i sin kontext där en genetisk biomarkör kan ha betydelse vid en cancerform men inte vara lika informativ i en annan. Man strävar därför efter att generera ett synopsis-svar där morfologi, IH-profil och eventuella molekylära analyser rapporteras tillsammans.
Nedan följer en fördjupning kring material och metoder.
Flytande biopsier – ett minimalinvasivt alternativ
Flytande biopsier är ett samlingsnamn för analyser av tumörrelaterat material som kan isoleras från olika kroppsvätskor. Till skillnad från traditionella vävnadsbiopsier, där det krävs ett invasivt ingrepp för att ta prov direkt från tumören, är flytande biopsier minimalinvasiva. Det vanligaste provmaterialet är blod (plasma eller serum), men analyser kan även utföras på urin, cerebrospinalvätska, pleuravätska, ascites och saliv, beroende på tumörtyp och klinisk frågeställning. Principen bygger på att tumörceller och/eller deras beståndsdelar frisätts till kroppsvätskorna och kan detekteras och analyseras med känsliga metoder.
Flera olika tumörrelaterade komponenter kan analyseras i flytande biopsier:
-
Cirkulerande Tumörceller (CTCs): Intakta tumörceller från primärtumören eller metastaser som hittas i blod eller annan kroppsvätska.
– Styrka: Möjliggör analys av hela celler och har prognostiskt värde i sig själva i vissa tumörformer.
– Svaghet: Extremt sällsynta och tekniskt utmanande att isolera och analysera på ett standardiserat sätt. Heterogenitet och osäker viabilitet kan komplicera tolkningen.
-
Exosomer: Små vesiklar (förenklat bubblor) som utsöndras av celler, inklusive tumörceller. De innehåller proteiner, lipider och nukleinsyror (DNA, mRNA, miRNA) från ursprungscellen.
– Styrka: Skyddar sitt innehåll från nedbrytning och kan ge information om ursprungscellens status.
– Svaghet: Isolering och specifik analys av tumör-exosomer är komplex och ännu inte standardiserad för kliniskt bruk.
-
Cirkulerande mikroRNA (miRNA): Korta, icke-kodande RNA-molekyler som reglerar genuttryck och kan frisättas till cirkulationen. Tumörspecifika miRNA-profiler har identifierats.
– Styrka: Relativt stabila i kroppsvätskor och kan spegla tumörbiologiska processer.
– Svaghet: Biologin är komplex, och det saknas konsensus kring standardiserade analysmetoder och tolkning för kliniska tillämpningar.
-
Cirkulerande Tumör-DNA (ctDNA): Fragmenterat DNA som frisätts från tumörceller till cirkulationen (främst via apoptos och nekros). Detta är för närvarande den mest studerade och kliniskt använda analysen från flytande biopsier.
Cirkulerande tumör-DNA (ctDNA)
Analys av ctDNA möjliggör minimalinvasiv monitorering av tumörens molekylära profil och sjukdomsutveckling i realtid. Kliniskt är metoden särskilt användbar i situationer där invasiva vävnadsbiopsier är svåra att utföra, kontraindicerade eller där tidigare biopsimaterial är otillräckligt för molekylär analys. Detta är exempelvis vanligt vid metastaserad sjukdom, där upprepade biopsier ofta är svårgenomförbara, vid svårtillgängliga tumörlokalisationer, eller när patientens kliniska tillstånd innebär risker med ett invasivt ingrepp.
I klinisk praxis används ctDNA-analys framför allt inom följande områden:
Diagnostik och behandlingsprediktion:
– Identifiering av mutationsprofiler som möjliggör riktad behandling, exempelvis EGFR-mutationer vid lungcancer, där analys av ctDNA är etablerad klinisk rutin vid begränsad tillgång till vävnadsprov.
– Analys av BRCA1/2-mutationer hos patienter med kastrationsresistent prostatacancer för att identifiera kandidater för behandling med PARP-hämmare.
Monitorering av behandlingssvar: Uppföljning av mutationsförekomst under pågående behandling för tidig bedömning av terapeutiskt svar eller resistensutveckling, exempelvis hos patienter med lungcancer under EGFR-hämmarbehandling.
En applikation som förväntas bli mer använd under kommande år är också Minimal Residual Disease (MRD) och tidig upptäckt av recidiv: Kvantifiering av tumörspecifika mutationer efter kirurgisk eller systemisk behandling, särskilt vid tidig upptäckt av recidiv av bröst-, kolon- och lungcancer, där ctDNA i vissa studier visar lovande resultat att identifiera återfall innan kliniskt eller radiologiskt påvisbar sjukdom. Detta förutsätter att man har identifierat tumörspecifika mutationer som därefter kan monitoreras med riktade, högkänsliga metoder. Inom hematologiska maligniteter har MRD-analyserna kommit längre och inom detta fält utnyttjas såväl flödesbaserade metoder som genetiska analyser riktade mot genetiska förändringar som är specifika för cancercellerna för att monitorera svar på behandling och sjukdomsåterfall.
Tidig Cancerupptäckt (Screening): Forskning pågår intensivt för att utvärdera om ctDNA kan användas för att upptäcka cancer på ett tidigt stadium hos asymtomatiska individer, särskilt i högriskpopulationer. Detta är dock fortfarande på forskningsstadiet och kräver mycket hög specificitet för att undvika falskt positiva resultat.
Flytande biopsier har hög specificitet men varierande sensitivitet beroende på tumörtyp, sjukdomsstadium och mängden cirkulerande DNA. Därför bör resultat från flytande biopsier alltid tolkas i klinisk kontext och ses som komplement till etablerade diagnostiska modaliteter snarare än en ersättning. Fortsatt utveckling av mer känsliga analytiska tekniker förväntas öka användbarheten av ctDNA-analys ytterligare framöver.
Författare: Viktor Ljungström, MD PhD, oktober 2025. Läs mer om författaren »
Referenser, figur:
- https://learngenomics.dev/docs/genomic-variation/single-nucleotide-variation/
- Nakatochi, M., Kushima, et al. Implications of germline copy-number variations in psychiatric disorders: review of large-scale genetic studies. J Hum Genet 66, 25–37 (2021).
- https://geneviatechnologies.com/bioinformatics-analyses/rna-seq-data-analysis/
- https://www.bdbiosciences.com/en-ca/learn/applications/immunohistochemistry
SWE-NP-0625-80003


