Kapitel 1
Biomarkörer för immuncheckpointhämmare
Immunterapi har transformerat behandlingslandskapet för många cancersjukdomar och utgör nu en central pelare inom modern onkologi. Utvecklingen av immuncheckpointhämmare har inneburit ett paradigmskifte och utöver dessa finns även flera andra typer av immunterapi som redan används idag. Denna text fokuserar på verkningsmekanismen för immuncheckpointhämmare och den centrala rollen biomarkörer spelar för att selektera patienter och predicera behandlingssvar.
Immuncheckpointblockad – att släppa på bromsen
När tumörcellerna ackumulerar fler och fler mutationer kan det bildas nya proteinmotiv, så kallade neoepitoper, som immunsystemets T-celler kan känna igen. Detta innebär att T-cellerna har en inneboende förmåga att känna igen och eliminera cancerceller. Denna process är dock hårt reglerad av så kallade immuncheckpoints vilka är molekylära bromsmekanismer som normalt förhindrar autoimmunitet men som tumörer kan utnyttja för att undkomma immunövervakning.
Två av de mest väletablerade checkpoint-axlarna är:
1. PD-1/PD-L1-axeln:
Programmed cell death protein 1 (PD-1) uttrycks på aktiverade T-celler. Dess ligand, PD-L1 (programmed death-ligand 1), kan uttryckas av tumörceller samt immunceller i tumörens mikromiljö. När PD-L1 binder till PD-1, skickas en inhiberande signal till T-cellen som därmed inaktiveras eller genomgår apoptos. Antikroppar riktade mot PD-1 eller PD-L1 blockerar denna interaktion och återställer T-cellens cytotoxiska potential mot tumörcellerna.
2. CTLA-4-axeln:
Cytotoxic T-lymphocyte-associated protein 4 (CTLA-4) är en annan inhiberande receptor på T-celler som konkurrerar med den co-stimulatoriska receptorn CD28 om att binda till B7-ligander på antigenpresenterande celler (APC). CTLA-4-blockad verkar primärt under T-cellsaktiveringsfasen i lymfoid vävnad och leder till en mer generell och bredare T-cellsaktivering.
Genom att blockera dessa negativa regulatoriska signaler möjliggör immuncheckpointhämmare att immunsystemet, och specifikt T-cellerna, kan montera ett effektivt angrepp mot cancercellerna.
Biomarkörer för prediktion av behandlingssvar
Att identifiera vilka patienter som har störst sannolikhet att svara på immuncheckpointhämmare är avgörande för att optimera nyttan och minimera onödig toxicitet och kostnad. Flera biomarkörer används idag kliniskt, men deras prediktiva värde och användningsområde varierar mellan olika tumörformer.
1. PD-L1-uttryck (immunhistokemi, IH):
- Mekanism: Högre uttryck av PD-L1 på tumörceller eller immunceller i tumörmikromiljön antas indikera en pågående, men undertryckt, immunreaktion som kan "släppas loss" av PD-1/PD-L1-blockad.
- Användning: PD-L1-status, mätt med IH, används som prediktiv biomarkör för beslut om behandling med immuncheckpointhämmare vid flera tumörformer, såsom icke-småcellig lungcancer (NSCLC), urotelial cancer, huvud-hals-cancer, trippelnegativ bröstcancer och magsäckscancer. Dock varierar den specifika antikroppen, scoringsystemen (TPS och CPS) och de kliniskt relevanta cut-off-värdena mellan olika indikationer och läkemedel.
- Begränsningar: PD-L1-uttryck är dynamiskt och heterogent inom tumören och kan påverkas av tidigare behandlingar. Dessutom svarar inte alla PD-L1-positiva patienter på behandling och en andel PD-L1-negativa patienter kan trots allt ha nytta av immuncheckpointhämmare. Det är således en imperfekt biomarkör.
2. Mikrosatellitinstabilitet (MSI) / mismatch repair-defekt (dMMR):
- Mekanism: Tumörer med dMMR (brist på DNA mismatch repair-proteiner) ackumulerar ett stort antal mutationer, särskilt i repetitiva DNA-sekvenser kallade mikrosatelliter, vilket leder till mikrosatellitinstabilitet. Denna höga mutationsbörda resulterar i produktion av många neoantigener, det vill säga proteinfragment med nya motiv som T-cellerna kan känna igen som främmande. Detta gör MSI/dMMR-tumörer generellt mer immunogena.
- Användning: MSI/dMMR är en stark prediktiv biomarkör för svar på PD-1/PD-L1-blockad. Det är en etablerad biomarkör vid bland annat kolorektalcancer och endometriecancer. Dessutom finns det läkemedel som godkänts för behandling av MSI/dMMR solida tumörer oavsett ursprung (tumöragnostiskt godkännande), baserat på biomarkörstatus snarare än tumörtyp, efter progression på tidigare behandling. MSI-status kan bestämmas via DNA-baserad analys med PCR eller NGS, medan dMMR-status bestäms via IH för MMR-proteinerna (MLH1, MSH2, MSH6, PMS2).
- Begränsningar: Även om MSI/dMMR är en stark prediktor, garanterar det inte behandlingssvar, och dess prevalens varierar kraftigt mellan olika tumörformer.
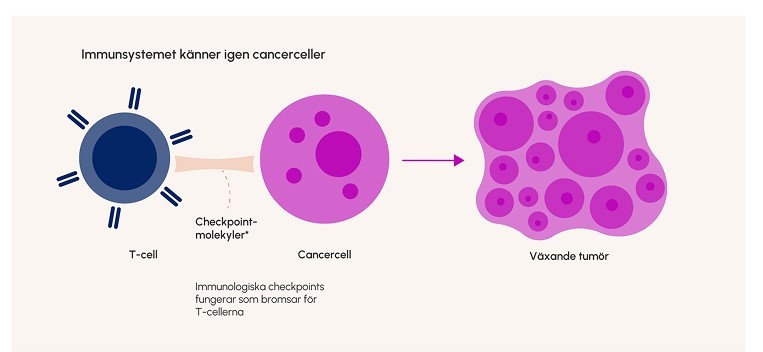
Figur 1. T-cellerna kan normalt känna igen främmande ämnen, till exempel avvikande molekyler som uttrycks av tumörcellerna. Cancercellerna kan undvika upptäckt genom att uttrycka bland annat PD-L1 som hämmar T-cellernas funktion.
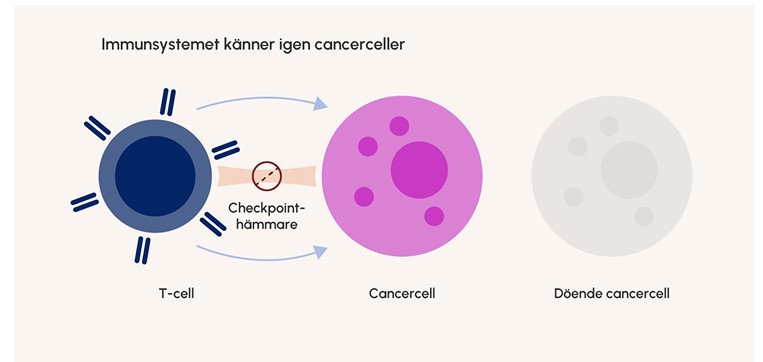
Figur 2. Genom att behandla med läkemedel som blockerar checkpointmolekylsignaleringen kan T-cellerna angripa cancercellerna.
Bättre biomarkörer behövs
Det är viktigt att understryka att varken PD-L1-uttryck eller MSI/dMMR-status är perfekta biomarkörer. Tumörens mikromiljö, patientens generella immunstatus, T-cellsinfiltration, tumörmutationsbörda (TMB, även om dess kliniska roll som prediktiv markör är mer omdebatterad och varierande), och andra ännu okända faktorer spelar också en avgörande roll för behandlingssvaret. Intensiv forskning pågår för att identifiera nya och förbättrade biomarkörer, eller kombinationer av markörer, som mer exakt kan förutsäga vilka patienter som skulle kunna ha nytta av immuncheckpointblockad.
Sammanfattning
Immuncheckpointhämmare är en typ av immunterapi som har revolutionerat onkologisk behandling genom att utnyttja kroppens eget immunförsvar. Prediktiva biomarkörer som PD-L1-uttryck (via IH) och MSI/dMMR-status är idag oumbärliga verktyg för att guida terapival för dessa behandlingar vid många tumörformer, även om de har sina begränsningar. Förståelsen för de komplexa interaktionerna mellan tumören och immunsystemet ökar kontinuerligt, och forskningen strävar efter att finjustera patientselekteringen och förbättra effekten av immunterapi.
Författare: Viktor Ljungström, MD PhD, oktober 2025. Läs mer om författaren »
SWE-NP-0725-80011


