Kapitel 5
Prover och preparering
När ett vävnadsprov anländer till patologiavdelningen omhändertas det så fort som möjligt för att undvika att materialet bryts ner. Som framgått av föregående kapitel är det också numera vanligt att man vill utföra många olika typer av analyser på materialet, allt från rutinmorfologisk bedömning till immunhistokemiska och molekylärpatologiska analyser och man får ofta vara varsam för att se till att materialet räcker. För att dessa analyser ska bli framgångsrika och resultaten tillförlitliga krävs en noggrann och standardiserad prepareringsprocess. Detta kapitel beskriver de vanligaste stegen från färskt prov till analysfärdigt material.
Standardprocessen: Formalinfixering och paraffininbäddning (FFPE)
Den absolut vanligaste metoden för att bevara vävnadsprover för histologisk undersökning är formalinfixering följt av paraffininbäddning (Formalin-Fixed Paraffin-Embedded, FFPE).
- Fixering: Så snart som möjligt efter att provet avlägsnats från patienten läggs det i formalin (vanligtvis buffrad 4% formaldehydlösning). Fixeringens syfte är att snabbt stoppa autolys (cellernas egen nedbrytning) och bakteriell förruttnelse, samt att stabilisera och härda vävnaden genom att korsbinda proteiner. Detta bevarar vävnadens morfologi för mikroskopisk undersökning. Tiden i formalin är kritisk; både under- och överfixering kan negativt påverka vävnadskvaliteten. Man använder därför standardiserade protokoll för fixeringstid beroende på vävnadens sammansättning.
- Dehydrering: Efter fixering dehydreras vävnaden genom att successivt passeras genom bad med ökande alkoholkoncentrationer för att avlägsna vattnet. Därefter används ett intermediärt lösningsmedel (ofta xylen) som går att blanda med både alkohol och paraffin för att avlägsna alkoholen.
- Inbäddning: Slutligen infiltreras vävnaden med smält paraffin, som sedan får stelna. Resultatet är ett solitt paraffinblock (det som kallas "kloss") där vävnadsbiten är helt innesluten och stabiliserad. Detta block kan sedan lagras i rumstemperatur under mycket lång tid och utgör grunden för både histologisk diagnostik och många molekylära analyser. Från blocken kan tunna snitt (typiskt 3-5 µm) tas för mikroskopi (för till exempel H&E-färgning eller immunhistokemiska undersökningar) eller för att extrahera DNA/RNA.
Mikrodissekering för anrikning av tumörceller
Tumörvävnad är sällan homogen. Den består ofta av en blandning av tumörceller, normala celler, bindväv (stroma), inflammatoriska celler och nekrotiska (döda) områden. Många molekylära analyser, särskilt de som syftar till att detektera mutationer i tumör-DNA, är känsliga för andelen tumörceller i provet (tumörcellhalt). En låg tumörcellhalt kan späda ut den tumörspecifika signalen, vilket kan leda till falskt negativa resultat eller svårtolkade data.
För att öka känsligheten i analysen kan det vara nödvändigt att mikrodissekera provet. Detta innebär att en patolog först granskar ett färgat snitt (oftast H&E) i mikroskop och identifierar de områden på snittet som har högst andel viabla (levande) tumörceller. Därefter isoleras dessa områden selektivt. Detta görs vanligen manuellt genom att man identifierar motsvarande område på paraffinklossen och tar snitt endast från detta område för DNA/RNA-extraktion. Man kan även skrapa bort de identifierade områdena från ett eller flera ofärgade snitt under mikroskopisk vägledning eller med mer avancerad teknik som lasermikrodissekering (Laser Capture Microdissection, LCM) men den sistnämnda metoden används framför allt i forskning. Målet är att anrika för tumörceller och därmed öka den relativa andelen tumör-DNA i det material som går vidare till extraktion och analys. Detta är ofta ett kritiskt steg för att säkerställa tillförlitligheten hos efterföljande molekylära tester, särskilt vid låg initial tumörcellhalt eller vid analys av heterogena tumörer.
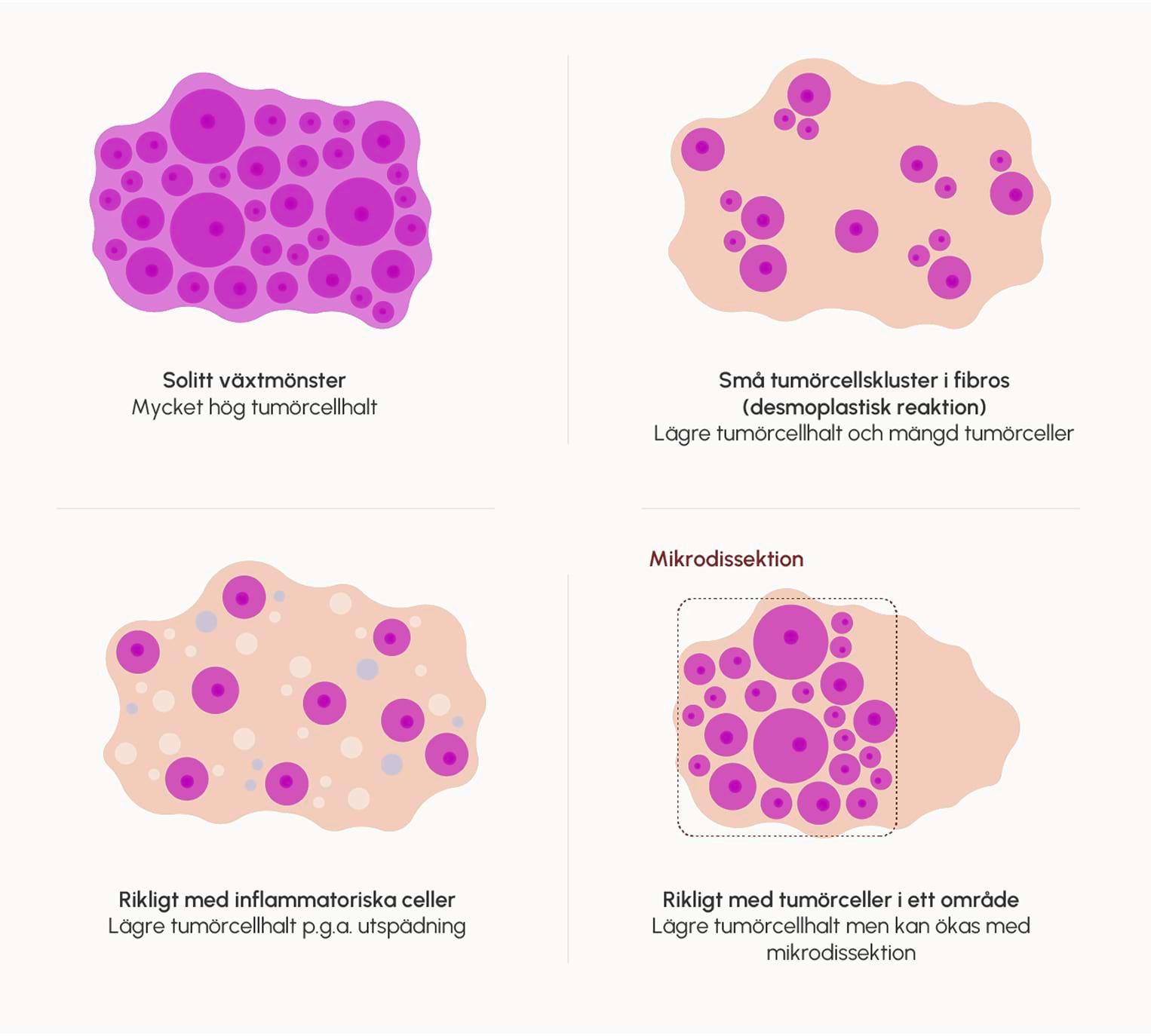
Figur 5. Bilden visar olika exempel på tumörcellhalt i tumörvävnad.
Det är svårt att sätta exakta gränser för hur låg tumörcellhalt som är för låg för att kunna genomföra analysen. Kopietalsvarianter (CNAs) kräver vanligen mer än 20 % tumörceller för att kunna analyseras tillförlitligt. Känsligheten för att hitta små mutationer beror på kvalitén på materialet (formalinfixerat material har sämre kvalitet än färskfruset dito) och på analysmetoden (droplet digital PCR är ofta känsligare än bredare analyser med genpaneler). I de fall där man analyserar fusionsgener med RNA-baserade metoder kan man teoretiskt sett identifiera dem i mycket låga tumörcellsfraktioner eftersom varje tumörcell kan uttrycka flera molekyler.
Materialkrav för DNA-baserad NGS-analys
Next-Generation Sequencing (NGS), till exempel riktad sekvensering där man analyserar en specifik panel av gener som är relevanta för en viss cancerform, ställer krav på både kvantitet och kvalitet på det DNA som används.
Kvantitet
Även om NGS-teknikerna blir allt känsligare, krävs fortfarande en viss mängd DNA för att bibliotekspreparationen (förberedelsesteget innan sekvensering) ska lyckas och för att få tillräcklig täckning (antal gånger varje bas i genomet läses av) för säker mutationsdetektion. Den exakta mängden varierar beroende på NGS-panelens storlek, den specifika plattformen och protokollet, samt kvaliteten på DNA:t. Generellt sett kan det röra sig om tiotals till hundratals nanogram DNA. I praktiken översätts detta ofta till att man behöver extrahera DNA från flera (5–10) något tjockare FFPE-snitt, vanligen omkring 10 µm, eller från en motsvarande mängd mikrodissekerat material. Behovet av exakt mängd snitt behöver alltid bedömas i det enskilda fallet. Avgörande faktorer är vävnadens storlek och tumörcellhalten men även den mängd DNA som krävs för den molekylära analysen. En liten biopsi med låg tumörcellhalt kan alltså vara mycket utmanande.
Kvalitet
Formalinfixering kan leda till fragmentering av DNA och kemiska modifieringar (till exempel deaminering av cytosin). Även om moderna extraktionsmetoder och NGS-protokoll är designade för att hantera FFPE-material, kan kraftigt degraderat DNA ge sämre resultat. Faktorer som fixeringstid, ålder på blocket och lagringsförhållanden påverkar DNA-kvaliteten. Klossar som legat i mer än fem år har mycket mindre sannolikhet att ge lyckade NGS-resultat än nyinsamlat material. För att säkerställa att materialet har tillräcklig kvalitet för analys med NGS görs kvalitetskontroller i flera steg, både före och under NGS-analysen.
Det är därför viktigt att redan vid provtagningen säkerställa att tillräckligt med representativt material skickas för analys och att det framgår i tydligt i remissen vilka biomarkörer eller analyser som önskas.
Biobankning för klinik och forskning
Material som hanteras på patologen sparas systematiskt i biobanker. Detta sker i enlighet med svensk lagstiftning (Biobankslagen) och möjliggör framtida diagnostik och forskning.
Kliniska Biobanker
De paraffinklossar (FFPE-block) som skapas i den kliniska rutinverksamheten arkiveras tillsammans med de mikroskopipreparat som genereras och utgör en del av den kliniska biobanken. Klossarna sparas under lång tid och kan vid behov tas fram igen för kompletterande analyser, antingen för patientens fortsatta vård (till exempel om nya behandlingsprediktiva markörer blir relevanta), i särskilda fall vid genetisk utredning av en släkting eller för kvalitetskontroll och forskning (efter godkännande från Etikprövningsmyndigheten och i enlighet med biobankslagen).
Forskningsinitiativ och färskfruset material
Parallellt med de kliniska biobankerna finns ofta forskningsspecifika biobanker eller insamlingar kopplade till studier eller forskningsinfrastrukturer. I dessa sammanhang är det inte ovanligt att man även samlar in och sparar färskfruset material. I stället för att fixeras i formalin fryses vävnadsbiten snabbt ner (ofta i flytande kväve eller vid -80°C) kort efter provtagningen. Frysning bevarar generellt DNA, RNA och proteiner i ett mindre skadat tillstånd jämfört med FFPE-processen, vilket kan vara fördelaktigt för vissa typer av molekylära analyser, särskilt storskaliga genomiska eller transkriptomiska studier. Tillgången till färskfruset material kräver en dedikerad logistik vid provtagningstillfället och utnyttjas idag relativt sällan för rena kliniska analyser.
SWE-NP-0625-80006



