Kapitel 2
Grunderna inom cancerbiologi
Cancer har en lång historia som sträcker sig ända tillbaka till antiken och vissa källor tyder på att bröstcancer upptäcktes redan 3000 f.Kr. Om man ser till utvecklingen i närtid har förekomsten ökat med cirka 40 procent sedan 1970-talet och fortsätter att öka. Minst var tredje person i Sverige kommer att få ett cancerbesked under sin livstid. Man känner till cirka 200 olika cancersjukdomar. Varje cancersjukdom behöver karakteriseras var och en för sig, vilket är en utmaning.
Samtidigt har överlevnaden generellt förbättrats och dödligheten minskat stadigt. Mellan 1969 och 2023 minskade dödligheten i cancer med 24 procent för kvinnor och 30 procent för män. Tioårsöverlevnaden har ökat till över 70 procent att jämföra med 35 procent för män och 46 procent för kvinnor i början av 1980-talet.
Tack vare förbättrad vävnadsdiagnostik inklusive immunhistokemiska markörer, förfinade molekylärpatologiska metoder inklusive heltäckande genomisk profilering (CGP), utvecklingen av vätskebiopsier och framsteg inom bilddiagnostik (inklusive digitalisering och AI-stöd) har både kunskap och förståelse för cancerns biologi avsevärt ökat. Man kan nu få en mer komplett bild av de genetiska förändringarna som sker i cancerceller samt mekanismerna bakom uppkomsten av cancer.
Här kommer vi gå igenom cancerns kännetecken, vad klonal evolution i cancer innebär och introducera mutationsbegreppet, det vill säga grunderna inom cancerbiologi.
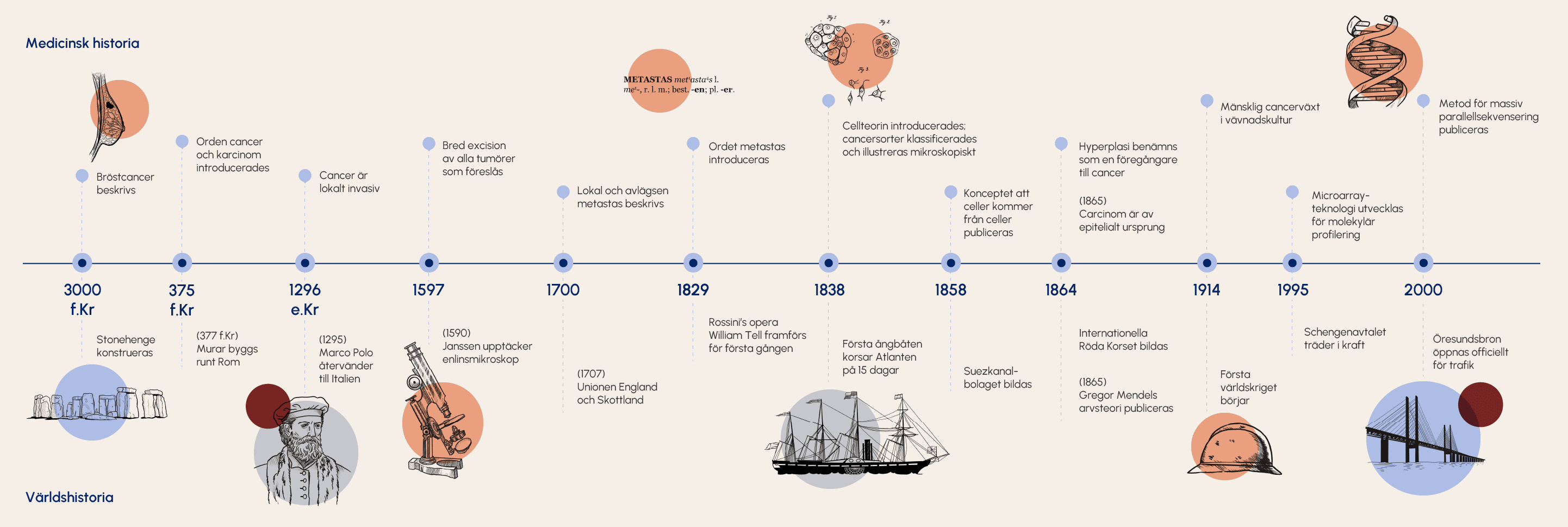
Figur 3. Cancerforskningens historia (utvalda delar).
Anpassad efter: Nacer D.F. (2024) Decoding pan-cancer complexity. Multiomic insights from the lung and breast. [Doctoral Thesis (compilation), Department of Laboratory Medicine]. Lund University, Faculty of Medicine.
Cancer grundar sig i genetiska förändringar
Cancer är i grunden ett tillstånd där genetiska mutationer ger cellerna en konkurrensfördel gentemot normala celler. Dessa mutationer kan leda till en rad förändringar, däribland ökad celldelning genom att cellcykelkontrollen minskas. Normalt regleras celldelningen noggrant av en rad mekanismer, men när dessa kontroller försvagas kan celler börja dela sig okontrollerat. Detta resulterar i en snabbare tillväxttakt, där cellerna får möjlighet att föröka sig utan att stoppas av de normala signalerna som annars reglerar cellcykeln.
Utöver ökad celldelning spelar minskad apoptos en central roll i cancerutvecklingen. Apoptos är den process genom vilken celler genomgår programmerad celldöd, ett sätt för kroppen att bli av med skadade eller onödiga celler. När apoptos reduceras, överlever celler med skadliga mutationer längre än de borde, vilket bidrar till att dessa celler ackumulerar ytterligare mutationer och riskerar att bli mer aggressiva.
Sammanfattningsvis bygger cancer på att mutationer i cellernas DNA leder till störningar i normala regleringsmekanismer, såsom cellcykelkontroll och apoptos. Detta resulterar i en överdriven celltillväxt och ackumulering av ytterligare mutationer, vilket i sin tur ökar tumörens aggressivitet.1
Cancerväxt i patologirapporten
Patologens roll är ofta att avgöra om det är cancer i en biopsi från en förändring eller i bortopererad vävnad. Begreppen som används är kopplade till de olika stegen av cancerutveckling, till exempel hyperplasi, dysplasi, höggradig dysplasi och invasiv cancer.
Hyperplasi innebär en ökning av antalet celler inom en vävnad, oftast som ett svar på yttre stimuli eller hormonell påverkan. Detta är i sig inte en malign process, utan snarare en fysiologisk anpassning. Ett godartat exempel är endometriehyperplasi, där livmoderslemhinnan förtjockas som en följd av ökad hormonell stimulans.
Dysplasi beskriver en oregelbunden och abnorm cellutveckling där cellernas form, storlek och organisation förändras. Dessa förändringar visar på att cellerna tappat kontrollen över tillväxt och mognad, vilket kan vara ett tecken på en precancerös process. Det är viktigt att notera att dysplasi inte alltid leder till cancer, men att den utgör en varningssignal.
Höggradig dysplasi innebär en mer avancerad grad av cellförändringar, där den abnorma utvecklingen är utpräglad. I denna fas är cellerna inte längre lika beroende av de normala regleringsmekanismerna, vilket ökar risken för att de kan utvecklas till en invasiv cancer om åtgärder inte vidtas. Höggradig dysplasi betraktas ofta som ett precanceröst stadium där en noggrann uppföljning och, vid behov, behandling är avgörande för att förhindra att de onormala cellerna utvecklas ytterligare.
Invasiv cancer innebär att de maligna cellerna har brutit igenom det basalmembran som normalt avgränsar epitelvävnaden från underliggande strukturer. När cellerna väl har invaderat omgivande vävnad, öppnas möjligheten för spridning via blod- eller lymfsystemet, vilket kan leda till metastasering och en mer komplex sjukdomsbild.
Sammanfattningsvis illustrerar dessa begrepp en sekvens där celler först reagerar genom att öka i antal (hyperplasi), därefter genomgår en oregelbunden utveckling (dysplasi), som i sin mer avancerade form (höggradig dysplasi) signalerar en betydande risk för malign transformation. Slutligen, när cellerna blivit invasiva, har de övervunnit den normala vävnadsbarriären och utgör en betydligt större risk för metastasering och spridning. (Denna sekvens gäller för cancer som utgår från epitelceller. För cancersjukdomar som utgår från till exempel mjukdelar behöver man använda andra definitioner.)2
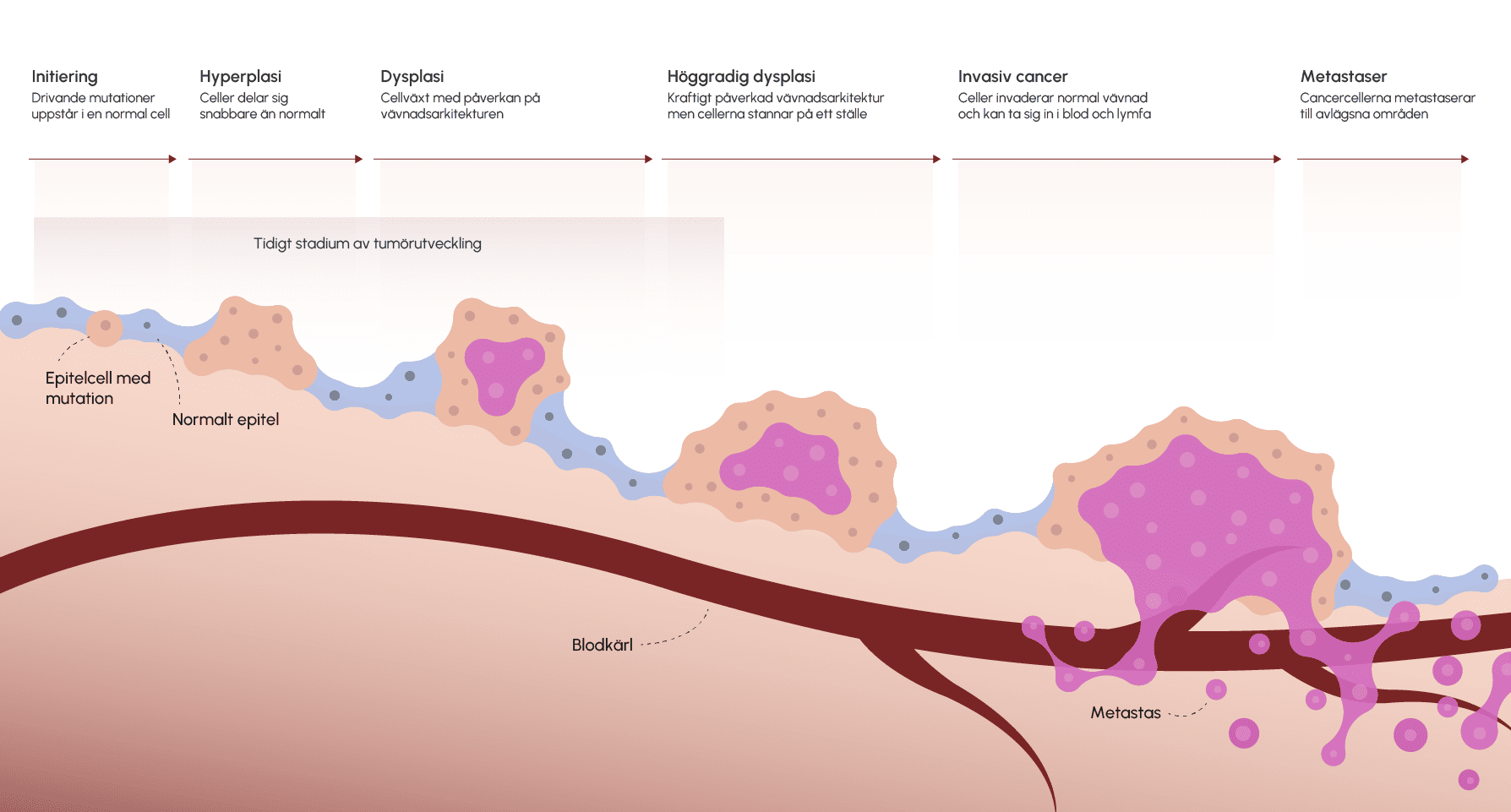
Figur 4. Figuren beskriver gradvis utveckling av malignitet.
Anpassad efter: Li, X., He, S. & Ma, B. Autophagy and autophagy-related proteins in cancer. Mol Cancer19, 12 (2020). https://doi.org/10.1186/s12943-020-1138-4.
Klonal evolution i cancer
Klonal evolution är en modell för att förstå hur cancer utvecklas. Den bygger på idén att en enda cell genomgår mutationer som gör att den får en överlevnads- eller tillväxtfördel i sin miljö, vilket leder till en expansion av denna “klon”. När denna cell delar sig uppstår inte exakta kopior utan nya mutationer kan uppstå under varje celldelning. Detta skapar en heterogen population av celler inom tumören, där vissa celler kan ha särskilda fördelar när det gäller överlevnad, invasion eller metastasering. Processen kan liknas vid naturlig selektion under evolutionen. Precis som organismer i ett ekosystem konkurrerar om resurser, konkurrerar olika cellkloner inom en tumör om näring, syre och utrymme. De celler som lyckas hantera de utmaningar som finns – till exempel genom att anpassa sig till en hypoxisk miljö eller genom att undvika immunsystemets angrepp – får en selektionsfördel. På så sätt dominerar de med mer adaptiva mutationerna över tid.
En annan viktig faktor i klonal evolution är den genetiska instabiliteten som ofta kännetecknar cancerceller. Genetisk instabilitet innebär att tumörceller lättare genomgår mutationer, vilket ökar den genetiska variationen inom tumören. Med en högre mutationsfrekvens skapas ett större utbud av kloner, likt hur en bred genetisk variation inom en art ökar chanserna att någon individ klarar av en förändrad miljö. Detta kan vara en förklaring varför aggressiva tumörer ofta karakteriseras av stor genetisk variation - både inom samma tumör (intratumoral heterogenitet) och mellan primära och metastatiska lesioner (intertumoral heterogenitet). Ju större variation, desto svårare är dessa tumörer att behandla effektivt. Den kontinuerliga “kapplöpningen” mellan mutation, selektion och expansion innebär att tumören ständigt utvecklas och anpassar sig, vilket i sin tur ställer höga krav på de behandlingsstrategier som utvecklas.
Klonal evolution är en process som pågår såväl under utveckling som behandling av cancer. Behandling innebär en ny miljö och de tumörceller som har en selektionsfördel överlever i den miljön. Därför ser man i många tumörformer att en kombinationsbehandling ger bättre resultat sannolikt delvis beroende på att man i större utsträckning kan få bort fler kloner. Samma princip föreligger även vid vissa infektionssjukdomar såsom hiv där en kombinationsbehandling krävs för att minska risken för resistensutveckling.
Sammanfattningsvis kan klonal evolution ses som en evolutionär selektionsprocess där tumörceller med fördelaktiga mutationer fortplantar sig snabbare och därmed dominerar populationen. De evolutionära flaskhalsarna som uppstår, exempelvis genom behandlingar eller förändrade mikro-miljöer, skapar ett selektionstryck där de mest motståndskraftiga cellerna har en överlevnadsfördel. Den genetiska instabiliteten i tumörceller bidrar ytterligare till denna process genom att kontinuerligt generera nya mutationer, vilket skapar en rik mångfald av cellkloner. Detta är grunden till tumörens anpassningsförmåga och är en central utmaning vid cancerbehandling.
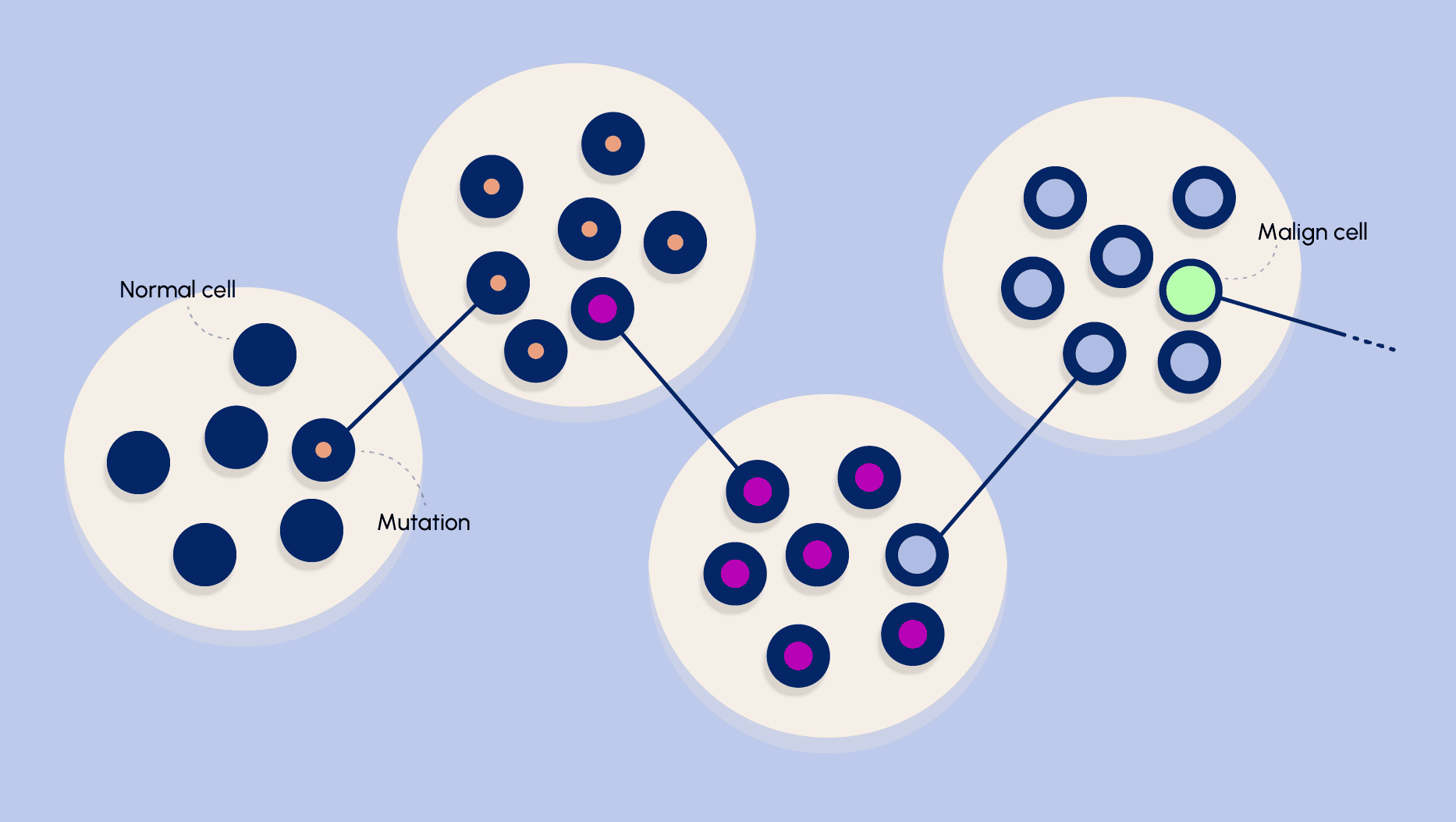
Figur 5. Klonal evolution.
Anpassad efter: Greaves, M., Maley, C. Clonal evolution in cancer. Nature 481, 306–313 (2012). https://doi.org/10.1038/nature10762.
Mutationsbegreppet
Mutationer är bestående förändringar i DNA-sekvensen och uppkommer spontant hos alla individer i alla generationer. Mutationer i eller i närheten av en gen kan ge upphov till nya egenskaper. De varianter vi föds med och som finns i kroppens alla celler kallar vi germlinevarianter, majoriteten av dessa är inte skadliga men några kan vara associerade med till exempel ökad risk för cancer. Mutationer som uppstår under vår livstid kallar vi i stället somatiska mutationer.
Orsaken till cancer är mutationer i en eller flera gener som kontrollerar hur celler fungerar, i synnerhet tillväxt och celldelning. Mutationer har därmed en central roll vid utvecklingen av cancer.
Mutationer kan uppstå:
- vid kopieringsfel i cellen. Fel vid kopieringen brukar cellen lyckas laga själv, men vid ungefär var tionde celldelning blir felet bestående och det uppstår en genetisk förändring, en mutation.
- av yttre faktorer, som exempelvis:
- Om DNA exponeras för vissa kemikalier eller strålning (radioaktiv strålning, UV-strålning etc.), kan det skadas. Om cellerna misslyckas med att laga skadorna, uppstår mutationer.
- Retrovirus som, när det infekterar en cell fogar in sitt DNA på flera ställen i värdcellens genom, kan röra om i DNA-sekvensen och orsaka mutationer.
Förmågan att eliminera celler med skadat DNA innan de blir cancerösa minskar med åldern, vilket är en orsak till att risken att drabbas av cancer ökar med ålder.
Olika typer av mutationer
Vilken effekt mutationen ger beror bland annat på vilken typ av förändring det är men framför allt var i genomet den uppstår.
Mutationer kan vara mindre händelser där en eller flera baser i genomet har förändrats men de kan också utgöras av stora händelser där delar av eller hela kromosomer försvinner eller tillkommer. Vi delar ofta upp mutationer i små avvikelser och kromosomavvikelser.
Nedan exempel på olika typer av små avvikelser:
- Substitution. När en eller ett par baser byts ut mot andra baser. Termen SNPs (Single Nucleotide Polymorphisms) används för att beskriva enbassubstitutioner som finns i mer än 1% av befolkningen. Ovanliga medfödda och somatiska enbassubstitutioner kallas i stället för SNVs (Single Nucleotide Variant).
- Insertion. En insertion innebär att baspar har lagts till DNA-sekvensen.
- Deletion. Enstaka baspar har försvunnit ur DNA-sekvensen.
Bland exemplen på stora avvikelser hittar vi:
- Duplikation. En del av kromosomen har kopierats upp och upprepas.
- Amplifiering: Ett ökat antal kopior av ett genomiskt parti.
- Kromosomal deletion: En del av kromosomen förloras.
- Inversion. Bakvänd DNA-sekvens. Delar av kromosomen har hamnat åt fel håll.
- Translokation. En del av kromosomen har hamnat på en annan plats, ofta på en annan kromosom.
Mutationens placering i genen
Var i genen mutationen uppstår har en viktig betydelse för mutationens effekt på cellens funktion och om den leder till någon effekt för cellens beteende.
En gen består (förenklat) av exoner, introner och en promotor.
När mutationer uppstår i kodade regioner (exoner) kan det ha en direkt påverkan på det proteinets struktur och funktion som just den genen kodar för. Ett exempel är när för tidig stopp-signal introduceras av en så kallad ”nonsens-mutation” vilket är ett vanligt utfall när en mutation har uppstått i ett exon. Proteinet blir då ofullständigt eller tillverkas inte alls och kan vara en mekanism för att slå ut proteiner som har till uppgift att begränsa cellens tillväxt (tumörsuppressorer).
Mutationer i icke-kodade regioner kan exempelvis vara mutationer i introner. Eftersom introner inte innehåller några instruktioner för hur protein ska tillverkas, har en mutation i en intron oftast inte någon effekt alls. Men det finns undantag. Generna innehåller instruktioner för var exonerna ska klippas ut från intronerna, så kallade splice sites och om en mutation uppstår i en sådan kan det leda till felaktig splitsning, vilket kan resultera i att introner felaktigt behålls i mRNA:t. Andra mutationer i icke-kodade regioner kan även vara mutationer i promotorer (platsen där transkriptionen initieras) och reglerelement, och påverkar inte proteinets uppbyggnad men kan påverka genens uttryck och reglering.
Konsekvenser för fenotypen
Konsekvenserna kan som sagt se olika ut och effekterna kan variera från att vara helt obetydliga till allvarliga. Substitutioner på basparsnivå i kodande regioner kan leda till att en aminosyra ersätts med en annan och därigenom förändrar funktionen på proteinet vilket till exempel kan leda till konstitutionell signalering i vissa signalvägar som har med celltillväxt att göra. Mutationer i regulatoriska regioner kan i stället påverka genuttrycket och leda till antingen ökad eller minskad proteinproduktion.
I nästa kapitel kan du läsa om proto-onkogener som är inblandade i celltillväxt, differentiering och överlevnad samt om tumörsuppressorgener som i stället bromsar cellens reglering.
Antal mutationer
För att en normal cell ska kunna bli en cancercell, krävs att det uppstår ett antal mutationer och att dessa inte repareras av kroppens kontrollsystem.
Cellpopulationer med somatiska mutationer kan hittas hos alla människor och ökar med stigande ålder. Det är dock en försvinnande liten andel som går vidare och blir till tumörer och cancer. Vissa celler kan ha samlat på sig tusentals mutationer under 20 års tid innan en tumörcell utvecklas, medan det för andra cancersjukdomar kan räcka med en enda genetisk förändring för att det ska bli en malign tumör. De senare hittar man ofta hos barn. Majoriteten av de mutationer vi hittar när vi sekvenserar tumörer är så kallade passagerarmutationer som inte har något stor effekt på cellens fenotyp. De mutationer som faktiskt påverkar cancercellernas fenotyp, så kallande drivande mutationer, är i absolut minoritet och man har i studier uppskattat att en tumör i genomsnitt har 1–10 drivande mutationer.3
I kommande kapitel kan du läsa mer om somatiska- och germlinemutationer.
Författare: Louise Candert, Medicinsk skribent, oktober 2025. Läs mer om författaren »
Granskat av: Viktor Ljungström, MD PhD
Källor
- Zhang, S., Xiao, X., Yi, Y. et al. Tumor initiation and early tumorigenesis: molecular mechanisms and interventional targets. Sig Transduct Target Ther 9, 149 (2024). https://doi.org/10.1038/s41392-024-01848-7
- RA Weinberg, The biology of Cancer
- Kumar S, Warrell J. et al. Passenger Mutations in More Than 2,500 Cancer Genomes: Overall Molecular Functional Impact and Consequences. Cell, Volume 180, Issue 5 (2020). https://doi.org/10.1016/j.cell.2020.01.032
SWE-NP-0525-80004


