Kapitel 2
Biomarkörer och precisionsmedicin
Precisionsmedicin, som även har kallats personalized medicine, innebär en ny era som påverkar och kommer påverka hälso- och sjukvården i grunden. Man pratar även om precisionsmedicin som ”framtidens medicin” och om ett paradigmskifte inom medicinen.
Det här är precisionsmedicin
Oavsett hur precisionsmedicin beskrivs så handlar det om att ta reda på så mycket som möjligt om patienten och/eller dennes sjukdom – med hjälp av de vetenskapliga och tekniska möjligheter som finns – för att kunna ta mer skräddarsydda beslut för varje enskild patient.
Informationsinsamling
Ofta behöver en stor mängd information samlas in och analyseras. Det är ett arbete som patienten delvis själv kan vara delaktig i genom att exempelvis, med hjälp av olika appar, registrera självupplevda symtom eller fysisk aktivitet i till exempel patientdagböcker.
Med hjälp av den senaste tidens utveckling kan man baserat på genetisk profil, specifika biomarkörer i kombination med avancerade diagnostikmetoder ta reda på stora mängder biologiska data från patienten. Denna mer avancerade form av diagnostisk kallas precisionsdiagnostik.
Läs mer om precisionsdiagnostik här »
En annat koncept är det man kallar ”big data” som handlar om att samla in, analysera och tolka stora mängder av bland annat genetiska, kliniska och real-world data, för att skräddarsy behandlingar till individuella patienter och förbättra medicinska beslut. Med hjälp av AI (artificiell intelligens) kan större mängder information analyseras effektivare och snabbare än vad som tidigare varit möjligt. Det innebär att man kan se hur en grupp individer med en viss genuppsättning eller med vissa specifika biomarkörsuttryck svarar på en särskild typ av behandling.
Precisionsbehandling kan anpassas efter både biomarkörsbaserade och icke-biomarkörsbaserade faktorer (ålder, kön, levnadsvanor, medicinska värden med mera).
Rätt vård till rätt patient vid rätt tidpunkt
Baserat på all denna information kan man sedan välja bästa möjliga behandling eller prevention för den specifika individen.
Skräddarsydd vård och behandling efter patientens specifika förutsättningar och behov med andra ord. Man kan också säga att det handlar om att ge rätt behandling till rätt patient i rätt tid.
Precisionsbehandling
Precisionsbehandlingar ges vid indikationer som kan bygga på biomarkörsbaserad information. Idag används ett 70-tal olika precisionsbehandlingar i svensk rutinsjukvård. Det kan röra sig om immunengagerande behandlingar, målriktade läkemedel samt infektionsläkemedel.
Vid en rad tumörsjukdomar är det numera praxis att genomföra molekylära analyser av tumören för att kunna ringa in genetiska alterationer på DNA eller RNA nivå, eller förändringar på protein-nivå. Det har lett till subgrupper vid olika cancersjukdomar, där vissa tumörer med återkommande genetiska avvikelser utgör undergrupper där mutationerna leder till behandlingsbara undergrupper. Det finns en rad olika målriktade läkemedelsbehandlingar som riktar sig mot just den tumörens specifika mutation eller proteinöveruttryck.
Exempel: Vissa bröstcancerceller har, på grund av genförändring, ett överuttryck av den humana epidermala tillväxtfaktorreceptorn 2 (HER2). HER2 signalerar celldelning till tumörcellerna. Det finns sedan drygt 20 år tillbaka en monoklonal antikropp som blockerar HER2-receptorn. Denna behandlingsmöjlighet har förbättrat överlevnaden för den femtedel av de bröstcancerpatienter som har HER2-positiv sjukdom (som tidigare hade dålig prognos).
Eftersom olika individer har olika genuppsättning, samt att olika tumörer har olika gen- och proteinuttryck kan effekten av ett och samma läkemedel ge olika effekt både beträffande förmågan till bot samt risken för biverkningar hos olika individer. Detta eftersom genetiska faktorer är viktiga för läkemedelseffekter. Ett flertal olika gener styr hur ett läkemedel tas upp, bryts ner och vilken verkan läkemedlet har på olika organ. Dessa gener kan förekomma i olika varianter. Farmakogenetiska tester kan ge god vägledning när det finns olika läkemedel att välja mellan som ger olika biverkningar. Genom de här möjligheterna att ge en mer träffsäker behandling blir inte bara behandlingarna effektivare för patienten utan onödigt lidande i form av eventuella biverkningar av läkemedlet kan även minskas.
Fördelar vs. nackdelar med precisionsmedicin
Ofta lyfts fördelarna med precisionsmedicin fram, men som med allt annat finns det även baksidor och en del risker.
Precisionsmedicinsk behandling kan tänkas ge följande fördelar:
- effektivare behandlingar och bättre behandlingsresultat
- möjlighet för hälso- och sjukvården att ge rätt behandling i rätt tid till patienter
- bättre överlevnad
- möjlighet att identifiera sjukdom tidigt och därmed kunna förhindra eller lindra sjukdomen
- underlätta för patienter att hantera sin sjukdom
- kortare sjukhusvistelser.
Nackdelar och risker med precisionsmedicin:
Man kan även se risker bland annat gällande personlig integritet och patientsäkerhet.
En historisk tillbakablick
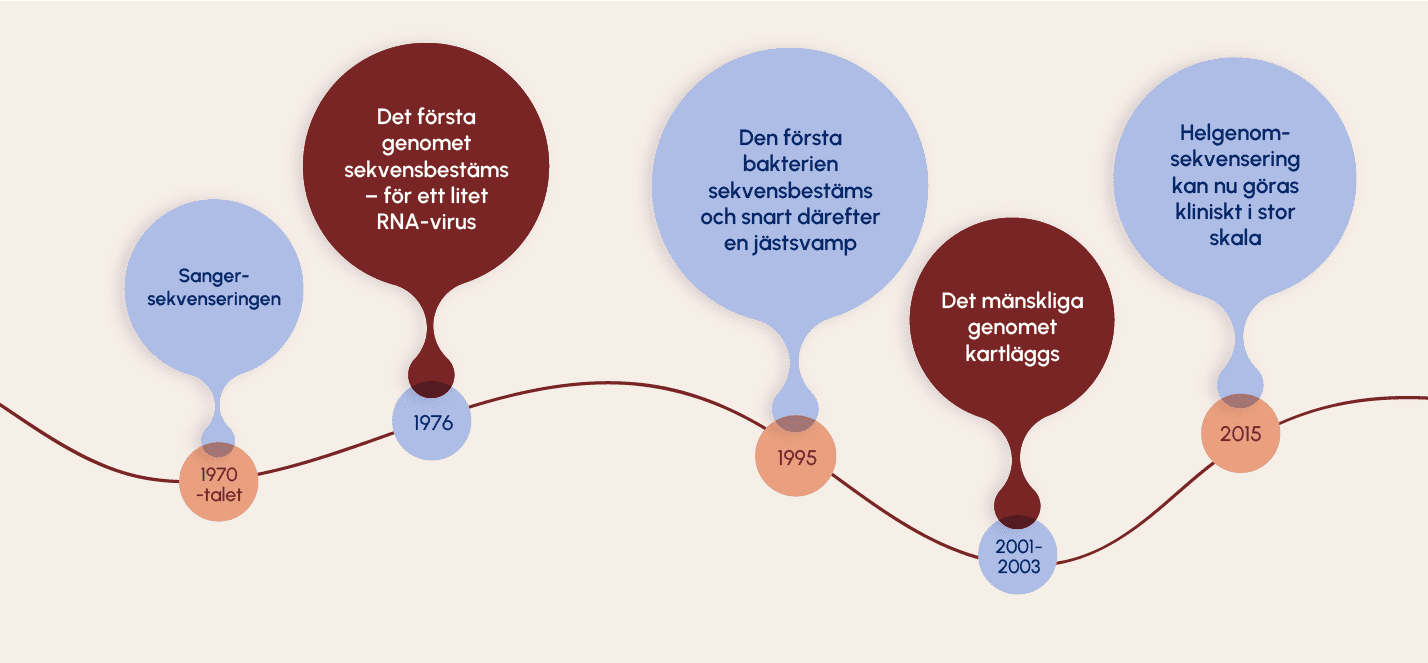
Man har länge känt till att celler innehåller arvsmassa och med hjälp av mikroskop har man kunnat studera tumörcellernas större kromosomavvikelser. Med den så kallade sangersekvenseringen, som kom på 1970-talet, kunde man börja analysera enstaka punktmutationer. Saken var den att man endast kunde sekvensera en liten del av arvsmassan i taget. Det behövdes därmed en kvalificerad gissning om vilken gen man skulle undersöka. Om den första gissningen visade sig vara fel fick man gå vidare och undersöka nästa gen och så vidare.
År 1976 sekvenserades det första genomet. Det tillhörde ett litet RNA-virus (genomet hos ett virus består endast av några tusen baspar). Därefter dröjde det till 1995 innan tekniken var så pass utvecklad att man kunde sekvensbestämma ett större genom, en bakterie. Ungefär vid samma tid kunde även genomet hos en jästsvamp sekvensbestämmas.
År 2001 tillkännagavs att det mänskliga genomet var kartlagt. Man hade nu tillgång till kunskap om hur de över tre miljarder baspar som utgör vårt DNA ligger ordnade. Arbetet leddes av Human Genome Organisation, HUGO under ledning av Francis Collins. Parallellt med HUGOs arbete genomförde ett privat företag, Celera Genomics, med forskaren Craig Venter i spetsen, samma arbete. Båda arbetena publicerades samtidigt i Science och Nature i november 2003. Det dröjde sedan ytterligare tjugo år, till 2023, innan precis hela DNA-sekvensen var kartlagd. Det beror till stor del på att stora delar av det mänskliga genomet utgörs av repetitiva delar som är svåra att läsa.
Snabb utveckling
Efter att det mänskliga genomet kartlades 2001 tog det sedan åratal tills dess att möjligheten fanns att kartlägga arvsmassan hos en enskild individ. Kostnaden uteslöt dessutom daglig klinisk användning. Därefter har en snabb utveckling skett inom ett flertal olika forsknings- och teknikområden var för sig. Det handlar bland annat om storskalig genetisk sekvensering, molelylärbiologi, högupplösande avbildningsteknik, biosensorer, genterapier, möjligheten att koppla upp och överföra stora mängder data samt artificiell intelligens (AI). När utvecklingen av alla de här områdena har sammanfallit i tid har de också kunnat kombineras.
Det stora genombrottet kom med den så kallade NGS-tekniken (Next Generation Sequencing) som innebär att man snabbt kan sekvensera stora mängder DNA samtidigt. Detta har banat väg för att kraftfulla gensekvenseringstekniker idag kan användas i svensk sjukvård.
Det har sedan 2015 funnits möjlighet att göra helgenomsekvensering kliniskt i stor skala, men det har tagit till runt år 2020 innan helgenomsekvenseringen införts på allvar i svensk sjukvård.
En sekvensering av hela genomet kan numera göras på mindre än ett dygn – om det är bråttom – annars tar det vanligtvis några veckor att få svar. Kostnaden är dessutom en bråkdel av vad det kostade att analysera det första genomet.
Figur 2. Utveckling av genomsekvensering.
En viktig milstolpe för precisionsmedicinen var när Amerikas tidigare president, Barack Obama, lanserade Precision Medicine Initiative i sitt State of the Union-tal 2015. En summa på 215 miljoner dollar investerades från presidentens budget för 2016 till utveckling av precisionsmedicinen.
Här i Sverige lanserades i december 2019 den svenska life science-strategin på uppdrag av regeringen. I den beskrivs precisionsmedicin så här:
”Med precisionsmedicin avses diagnostiska metoder och terapi för individanpassad utredning, prevention och behandling av sjukdom, applicerade på individnivå eller på delar av befolkningen. De nya möjligheter som precisionsmedicinen erbjuder baseras på senare års framsteg inom bland annat molekylära biovetenskaper (”omics”-teknologier) och bioinformatik, samt tillkomsten av nya högupplösande avbildningstekniker.”
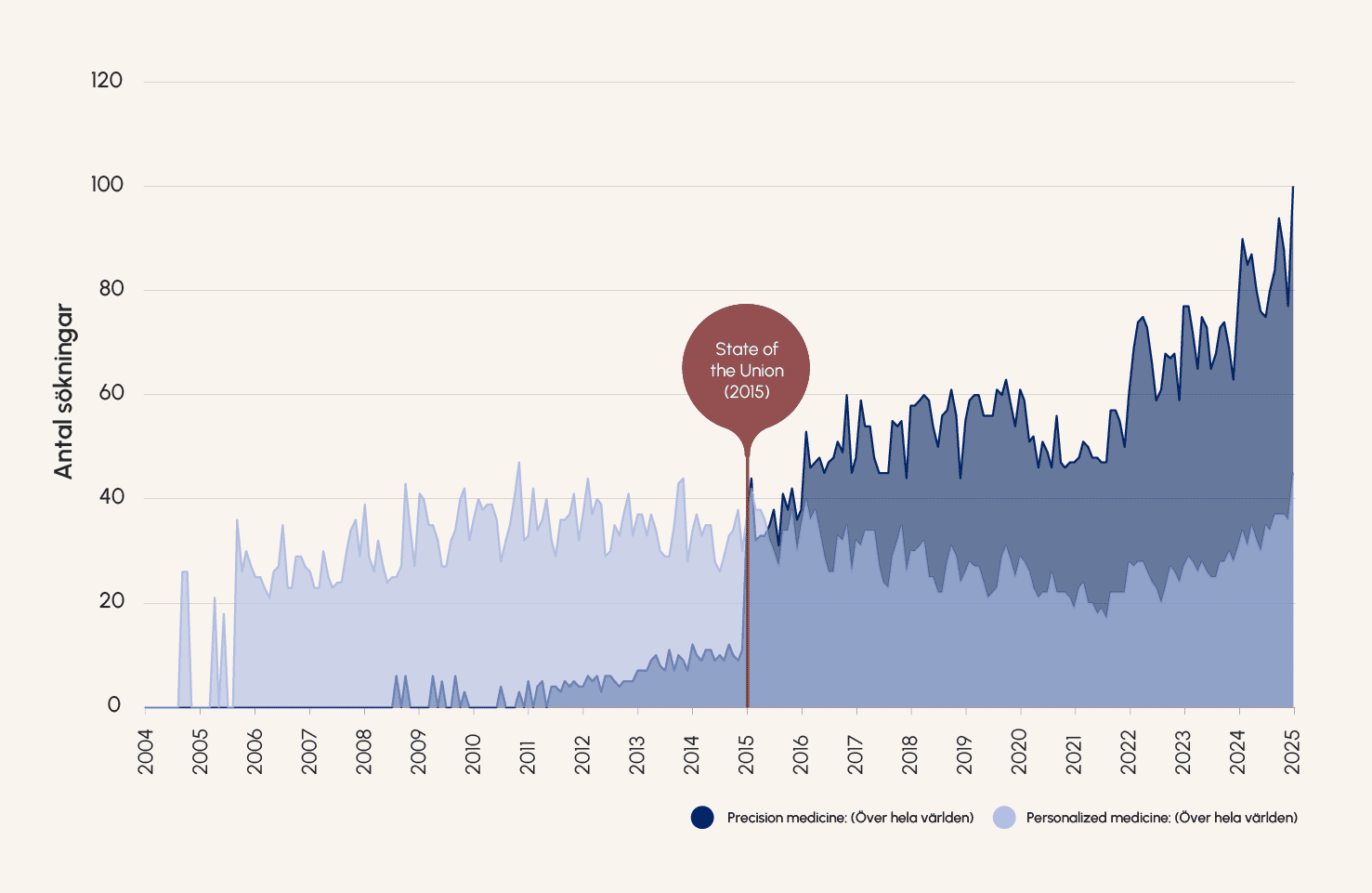
Figur 3. Uppkomsten av begreppet precisionsmedicin. Antal Google-sökningar över hela världen på termerna personalized medicine och precisionsmedicin från januari 2004 till januari 2025. Data från Google.
Stora möjligheter
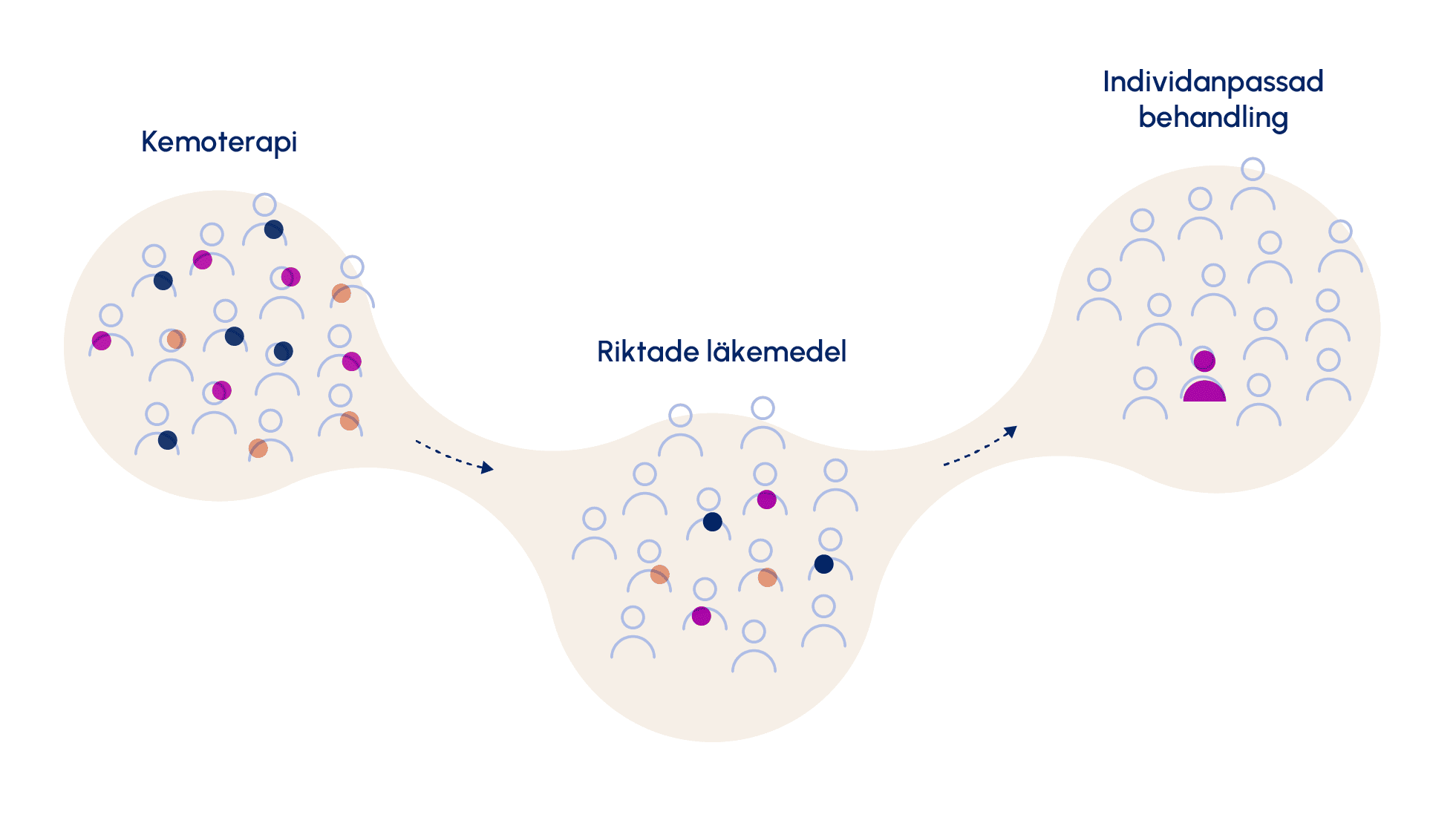
Vi har gått från att identifiera behovet av medicinska insatser på gruppnivå till en avgränsad grupp till att kunna identifiera vilka medicinska insatser som bäst torde gagna en specifik individ.
Exempel: År 2014 kom en drygt ettårig liten pojke med aggressiv, spridd neuroblastom till Astrid Lindgrens barnsjukhus. Vi kan kalla honom Oskar. Man inledde genast tuff cytostatikabehandling. Föräldrarna förbereddes på att Oskar skulle må dåligt av behandlingen, men ingen hade förväntat sig att han skulle bli så dålig som han faktiskt blev. Efter tredje cytostatikaomgången under en månad var han mycket, mycket dålig. Under ett halvår flyttades Oskar fram och tillbaka mellan barnonkologen och IVA och under månader krävdes dagliga blodtransfusioner. Oskar var fortfarande dödligt sjuk. Man beslöt sig för att göra en helgenomsekvensering, något som var ganska ovanligt 2014 och bara gjordes i vissa fall. Man misstänkte att genetiska mutationer kunde vara skälet Oskars cancer. Analyssvaret visade två saker. Det ena var att Oskar också hade sjukdomen Fanconis anemi, vilket förklarar varför han inte tålde cytostatikabehandlingen. Det andra var en specifik-mutation. Oskar kunde därför få en målriktad behandling mot denna mutation vilket möjliggjorde kirurgi och sedermera tumörfrihet.
Figur 4. Utveckling precisionsmedicin vid onkologisk behandling
Historien om Oskar är ett tydligt exempel på precisionsmedicin. Det vill säga hur Oskar först behandlas på gruppnivå för att sedan få sitt genom sekvenserat, två genmutationer upptäcks och varefter Oskar kan få en målriktad terapi som går på just den mutationen som han har.
Med dagens analysmetoder kan man analysera allt från en enda gen, till en panel av gener, till att kartlägga hela genomet. Man kan analysera på DNA-, RNA- och proteinnivå samt på metaboliter i förhållande till olika sjukdomar (inklusive de komplexa sjukdomarna). Denna tillgång till omikdata, tillsammans med anamnes och kliniska undersökningar, öppnar för helt nya möjligheter. För att allt detta ska vara möjligt är validerade biomarkörer en förutsättning.
När man kan anpassa prevention, diagnostik, insatser och uppföljning (utifrån de enskilde individens biologiska förutsättningar) efter individen kan man utöva precisionsmedicin. Detta är nästa steg i den historiska utvecklingen inom medicinen och skälet till att det kallas framtidens medicin och att man till och med talar om ett paradigmskifte inom medicinen.
Status idag
Sjukvården kraftsamlar för att kunna förflytta sig in i dessa framtidens möjligheter. Några exempel är de hubbar för utveckling och implementering som har etablerats i flera regioner. I exempelvis Stockholm, Västra Götaland, Uppsala och Skåne har precisionsmedicinska centra antingen redan etablerats eller planerar att snart öppna. Utredningar pågår kring juridiska förutsättningar för sekundäranvändning av patientdata som bland annat behövs för att diagnostisera nya patienter. Ett avgörande diagnostiskt verktyg för precisionsmedicin är riktad- och helgenom sekvensering, som idag används i allt större utsträckning i vården. Många patologer arbetar numera helt digitalt. Ytterligare ett exempel är hur man fört in AI i diagnostiken. AI-baserad bildanalys förekommer alltmer till exempel för bröstcancerpatologi. Fler AI-baserade verktyg väntas komma.
Områdena där vi kommit längst
I Sverige har vi varit tidiga med att använda den här nya generationens sekvenseringsteknologi för bred genetisk diagnostik särskilt inom några områden:
- cancer, fram för allt inom vissa tumörsjukdomar
- sällsynta genetiska sjukdomar
- infektionssjukdomar
I det här materialet har vi valt att fokusera på cancersjukdomar och hur biomarkörstestning kan vara till gagn inom cancervården.
Utmaningarna
Samtidigt som precisionsmedicin kan göra stor nytta finns en del hinder och det dyker hela tiden upp nya utmaningar.
En är att biomarkörstestningen skiljer sig mellan olika delar i landet och mellan olika tumörgrupper. En annan är att allt som analyseras inte alltid svaras ut och att det kan vara svårt för den enskilda klinikern att tolka det som svaras ut. Ibland kanske något analyseras där det idag ännu inte finns en godkänd behandling. Men om så är fallet ger analysen ändock möjlighet att söka efter en klinisk studie om patienten så önskar.
Patienter generellt vill vara delaktiga i besluten kring sin vård. Detta innebär ofta att de vill veta så mycket som möjligt och erbjudas möjlighet att delta i kliniska studier.
Insamlingen av patientdata och möjligheten att dela data som exempelvis sekundäranvändning av patientdata möter legala utmaningar som hindrar delning av patientdata. Kompetens inom områden som datavetenskap, biostatistik och bioinformatik behövs dessutom i sjukvården för att kunna stödja användning av patientdata.
Författare: Louise Candert, Medicinsk skribent, oktober 2025. Läs mer om författaren »
Granskat av: Viktor Ljungström, MD PhD
SWE-NP-0325-80004


